Schwefelsäure
In diesem Artikel erklären wir Ihnen Grundsätzliches zu schwefelsäurebasierenden Anodisierbädern und geben Tipps zur Konzentrationsbestimmung und -einstellung.
Inhalt
- 1. Grundsätzliches zur Wahl der Säurekonzentration im Anodisierbad
- 2. Messen der Säurekonzentration
- 3. Berechnung der Verdünnung
- 4. Entsorgung verbrauchter Anodisierbäder
- 5. Tabelle der Schwefelsäurekonzentrationen
1. Grundsätzliches zur Wahl der Säurekonzentration im Anodisierbad
Die Säurekonzentration hat - zusammen mit anderen Parametern - einen erheblichen Einfluss auf die Schichtbildung. Da - wie nachfolgend erklärt wird - im Bad grundsätzlich zwei konkurrierende Prozesse ablaufen, lässt sich durch geschickte Wahl der Konzentration der eine oder andere Prozess bevorzugen.
Während der Schichtbildung laufen im Bad gleichzeitig mehrere Prozesse ab, von denen uns hier nur die beiden wichtigsten interessieren sollen:
- Der Schichtaufbau mit Bildung der Eloxalkeramik durch Reaktion des elektrolytisch erzeugten Sauerstoffs mit dem Oberflächenaluminium
- Der teilweise Schichtabbau durch die Auflösung von Teilen der gebildeten Schicht durch die vorhandene Schwefelsäure
Daraus folgt:
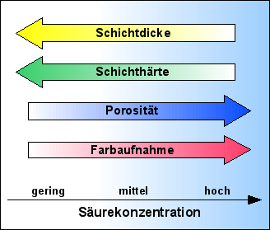
- je höher die Säurekonzentration ist, desto größer werden die Poren in der Schicht, desto langsamer wächst aber auch die Schicht und umso weicher wird sie.
- je niedriger die Säurekonzentration ist, umso kleiner werden die Poren, umso schneller wächst die Schicht und umso härter ist sie.
- Je kleiner die Poren und je geringer ihre Anzahl, umso schlechter ist die Farbstoffaufnahme.
- Je größer die Poren und je größer ihre Anzahl, umso besser ist die Farbstoffaufnahme.
Die Konsequenzen daraus sind:
Möchte man eine möglichst harte, dicke Schicht erhalten (also hartanodisieren), setzt man die Säurekonzentration entsprechend herunter.
Möchte man eine möglichst gute Farbaufnahme erzielen - kommt es also hauptsächlich auf ein dekoratives Äußeres an - so wählt man eher höhere Säurekonzentrationen.
Ein Hinweis:
Durch Verwendung unseres Harteloxierzusatzes können auch in Säurebädern höherer
Konzentrationen sehr gute Harteloxalschichten erzeugt werden. Näheres dazu finden Sie in unserer technischen Mitteilung „TM-7 Hartanodisierung“ im Downloadbereich.
2. Messen der Säurekonzentration
2.1 Aräometer / Senkwaage
Das einfachste, schnellste und am häufigsten angewandte Messverfahren ist die Bestimmung der Dichte des Säurebades mit Hilfe eines Aräometers (Senkwaage). Dabei nutzt man das einfache Prinzip, dass ein Körper so weit in eine Flüssigkeit eintaucht, bis das Gewicht der Verdrängten Flüssigkeit gleich dem Gewicht des Körpers selbst ist. Wenn man den Körper mit entsprechenden Marken versieht, kann an diesen dann direkt die Dichte abgelesen werden.
Üblicherweise werden zugeschmolzene Glasaräometer verwendet, die als Gewicht Metallkügelchen enthalten und entsprechend kalibriert sind. Da die Dichte von Flüssigkeiten immer auch von der Temperatur abhängt, gelten die abgelesenen Werte eines Aräometers immer nur für eine bestimmte Temperatur, die üblicherweise auch auf der Skala angegeben ist.
Je nach der zu messenden Flüssigkeit gibt es Aräometer für verschiedene Dichtebereiche: für leichte Flüssigkeiten wie Alkohol (Dichte etwa 0,79g/cm³, 790g/Liter), die in Wasser gelöst sind, verwendet man dann einen Bereich von 0,79 (reiner Alkohol) bis 1,00 (reines Wasser = 1,00g/cm³) und kann so bestimmen, wie hoch die Konzentration an reinem Alkohol z.B. in Spirituosen ist. Je enger Minimal- und Maximalwert zusammenliegen, desto genauer kann man ablesen, desto schmaler ist aber auch der Bereich, in dem die Senkwaage verwendet werden kann. Man sollte sich überlegen, welche größten oder kleinsten Dichten angenommen werden können und danach das Aräometer wählen - oder man besorgt sich eine Anzahl Senkwaagen mit aufeinander folgenden Messbereichen und kann so sehr exakt messen.
Die Messung mit einem Aräometer ist denkbar einfach: man lässt dieses langsam in die zu messende Flüssigkeit tauchen und liest dann den Wert ab, an dem der Flüssigkeitsspiegel steht. Zu diesem Dichtewert liest man nun einfach den Prozentwert aus der Tabelle ab.
2.2 Massebestimmung von Volumen
Dies ist eine weitere einfache Methode. Dabei misst man ein genaues Volumen des Anodisierbades ab und ermittelt dessen Masse. Durch die einfache Formel
kann dann die Dichte berechnet und damit über die Tabelle auf die Säurekonzentration geschlossen werden.
Ein Beispiel:
Dem zu prüfenden Anodisierbad werden mit einem Messkolben 50cm³ entnommen und diese gewogen. Mit dem Ergebnis (55,2g) wird nun anhand obiger
Formel die Dichte zu 55,2g/50cm³ = 1,104g/cm³ berechnet. Die Tabelle liefert dann für diese Dichte eine Säurekonzentration von etwas über 15%.
Bitte beachten Sie, dass in die Dichte des Anodisierbades natürlich auch andere Stoffe wie gelöstes Aluminium, Zusätze etc. einfließen und das Ergebnis etwas verfälschen können. Durch die deutlich höhere Konzentration an Schwefelsäure sind die Abweichungen aber meist vernachlässigbar. Für eine genaue Bestimmung des Säuregehaltes muss eine sogenannte Titration durchgeführt werden, wie sie im nächsten Abschnitt ansatzweise beschrieben ist.
2.3 Titration
Bei der Titration wird die Menge einer unbekannten Säure bestimmt, indem eine Base exakt bekannter Konzentration solange hinzugegeben wird, bis die Lösung neutral reagiert (also den pH-Wert 7 hat). Die Überwachung des pH-Wertes erfolgt dabei entweder mit Hilfe spezieller Farbstoffindikatoren, die durch Farbumschlag die Neutralität der Lösung anzeigen oder (heutzutage vermehrt, da genauer) durch elektronische ph-Messgeräte.
Die Titration ist deutlich genauer als die zuvor beschriebenen Verfahren zur Dichtemessung, da nur die wirklich vorhandene Säure und nicht gelöstes Aluminium etc. ins Messergebnis einfließen.
Der Aufwand ist aber auch deutlich höher und normalerweise unverhältnismäßig, wenn es nur um Auffrischung eines vorhandenen Bades geht.
Deswegen verzichten wir hier auf eine genauere Darstellung des Verfahrens. Bei Interesse lassen sich leicht vielfältige Informationen zu diesem Thema im Internet finden.
3. Berechnung der Verdünnung
Da die im Handel erhältliche Säure oftmals eine andere (=höhere) Konzentration besitzt als benötigt wird, lautet eine wichtige Frage in der Praxis:
„Mit welcher Menge Wasser muss ich Säure der Konzentration X Prozent verdünnen, um Säure der
Konzentration Y Prozent zu erhalten?“
Im Folgenden werden die dazu nötigen einfachen Schritte erklärt und das Ganze an einem anschaulichen Beispiel durchgerechnet.
Bei der Verdünnung von Flüssigkeiten geht man praktisch immer über die Massen (oder - eigentlich falsch ausgedrückt - das "Gewicht") der Komponenten. Dies hat seinen Grund darin, dass sich durch das Mischen die Volumina durchaus ändern (und zwar nichtlinear), während die beteiligten Massen konstant bleiben: 1 Liter Wasser und 1 Liter Säure ergeben gemischt nicht exakt 2 Liter verdünnter Säure, während 1kg Säure + 1kg Wasser gemischt weiterhin exakt 2kg „wiegen“. Dieses Phänomen nennt man Volumenkontraktion.
Benötigt man eine bestimmte Konzentration, so geht man wie folgt vor:
- Man sucht für die gewünschte Konzentration in der Tabelle die zugehörige Menge an Schwefelsäure (Spalte 3, „Gramm H2SO4/l“) und multipliziert diese mit dem gewünschten Volumen in Litern.
- Dann sucht man auf gleiche Art die Menge an Schwefelsäure, die pro Liter in der zur Verfügung stehenden Säure vorhanden ist.
- Durch Teilung der benötigten Menge aus (1.) durch die pro Liter vorhandene Menge aus (2.) ergibt sich, wieviel Liter Ausgangssäure genommen werden müssen.
- Diese Menge wird dann abschließend einfach mit reinem (destillierten) Wasser bis auf das gewünschte Volumen aufgefüllt.

Da sich alle Säuren beim Verdünnen massiv erwärmen, sollten Sie die Säuren langsam in viel kaltes Wasser einrühren, nie umgekehrt! Es besteht sonst Spritz- und Verdampfungsgefahr! Für das obige Verfahren heisst dies, dass wir die in (3.) berechnete Säuremenge
bereits in eine passende Menge (kalten) Wassers einrühren und schließlich nur noch den Rest bis zum gewünschten Endvolumen auffüllen.
Nicht vergessen: Schutzhandschuhe und vor allem Schutzbrille sowie alte Kleidung tragen!
Ein Beispiel: Wir haben 38%ige Batteriesäure zur Verfügung und möchten mit dieser 10 Liter 15%ige Säure
herstellen.
- Im ersten Schritt suchen wir in der Tabelle nach der Menge an Schwefelsäure pro Liter bei 15%. Dieses sind 165,30g.
Da wir jedoch 10 Liter benötigen, müssen wir natürlich auch die zehnfache Menge an reiner Schwefelsäure einsetzen:
10 x 165,30g = 1653,0g
- Im zweiten Schritt suchen wir in der Tabelle die Menge Schwefelsäure, die in einem Liter unserer Ausgangssäure (38%) vorhanden ist. Dies sind 488,50g
- Die Division der benötigten Menge an reiner Säure (1653,0g) durch die zur Verfügung stehende Menge pro Liter (488,50g) liefert
uns das benötigte Volumen an Batteriesäure:
1653,0g / (488,50g/Liter) = 3,38 LiterDieses Volumen messen wir in einem Behälter ab.
- Da wir 10 Liter Säure herstellen möchten, aber nur 3,38 Liter Säure benötigen, können wir zuerst z.B. 5 Liter Wasser vorlegen, in das wir dann langsam die abgemessene Säure (3,38 Liter) einrühren. Es entstehen etwa 8 Liter Säurebad, das wir zum Schluß vorsichtig mit Wasser auf die gewünschten 10 Liter auffüllen - fertig!
4. Entsorgung verbrauchter Anodisierbäder
Entsorgungshinweise zu verbrauchten Anodisierbädern finden Sie in unserer „TM-5 Entsorgung von Chemikalien“ im Downloadbereich.
5. Tabelle der Schwefelsäurekonzentrationen
Im Folgenden finden Sie tabellarisch die Konzentrationen von Schwefelsäure. Unter „Bemerkungen“ finden Sie die Bereiche markiert, für die jeweiligen Säurekonzentrationen üblicherweise eingesetzt werden sollten.
| H2SO4 in % |
Dichte ρ (+20°C) in g/cm³ |
H2SO4 in g/l |
H2SO4 in mol/l |
Bemerkungen |
|---|---|---|---|---|
| 1 | 1,0051 | 10,05 | 0,103 | |
| 2 | 1,0118 | 20,24 | 0,206 | |
| 3 | 1,0184 | 30,55 | 0,312 | |
| 4 | 1,0250 | 41,00 | 0,418 | |
| 5 | 1,0317 | 51,59 | 0,526 | Hartanodisierung (*1) |
| 6 | 1,0385 | 62,31 | 0,635 | |
| 7 | 1,0453 | 73,17 | 0,746 | |
| 8 | 1,0522 | 84,18 | 0,858 | |
| 9 | 1,0591 | 95,32 | 0,972 | |
| 10 | 1,0661 | 106,60 | 1,087 | |
| 11 | 1,0731 | 118,00 | 1,203 | |
| 12 | 1,0802 | 129,60 | 1,321 | Dekorative Anodisierung |
| 13 | 1,0874 | 141,40 | 1,442 | |
| 14 | 1,0947 | 153,30 | 1,563 | |
| 15 | 1,1020 | 165,30 | 1,685 | |
| 16 | 1,1094 | 177,50 | 1,810 | |
| 17 | 1,1168 | 189,90 | 1,936 | |
| 18 | 1,1234 | 202,40 | 2,063 | |
| 19 | 1,1318 | 215,00 | 2,192 | |
| 20 | 1,1394 | 227,90 | 2,324 | |
| 21 | 1,1471 | 240,90 | 2,456 | |
| 22 | 1,1548 | 254,10 | 2,591 | |
| 23 | 1,1626 | 267,40 | 2,726 | |
| 24 | 1,1704 | 280,90 | 2,864 | |
| 25 | 1,1783 | 294,60 | 3,004 | |
| 26 | 1,1862 | 308,40 | 3,144 | |
| 27 | 1,1942 | 322,40 | 3,287 | |
| 28 | 1,2023 | 336,60 | 3,432 | |
| 29 | 1,2104 | 351,00 | 3,579 | |
| 30 | 1,2185 | 365,60 | 3,728 | |
| 31 | 1,2267 | 380,30 | 3,878 | |
| 32 | 1,2349 | 395,20 | 4,029 | |
| 33 | 1,2432 | 410,30 | 4,183 | |
| 34 | 1,2515 | 425,50 | 4,338 | |
| 35 | 1,2599 | 441,00 | 4,496 | |
| 36 | 1,2684 | 456,60 | 4,656 | |
| 37 | 1,2769 | 472,50 | 4,818 | Batteriesäure |
| 38 | 1,2855 | 488,50 | 4,981 | |
| 39 | 1,2941 | 504,70 | 5,146 | |
| 40 | 1,3028 | 521,10 | 5,313 | |
| 41 | 1,3116 | 537,80 | 5,483 | |
| 42 | 1,3205 | 554,60 | 5,655 | |
| 43 | 1,3294 | 571,60 | 5,828 |
(*1) Bei Verwendung unseres Harteloxierzusatzes kann auch mit Bädern für dekorative (=farbige) Anodisierungen (12-20% Säuregehalt) harteloxiert werden, so dass Sie nur ein einziges Anodisierbad benötigen.

